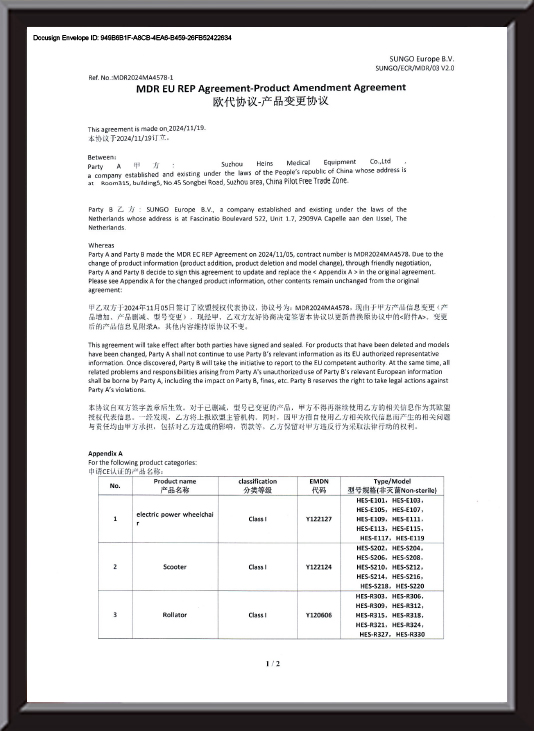
-
 YL-309SZOBRAZIT VÍCE YL-309S Automatický skládací výškově nastavitelný cestovní/přenosný elektrický skútr YL-309S je chytrý elektrický skútr navržený pro pohodlné cestování. Vyznačuje se automatickým skl...
YL-309SZOBRAZIT VÍCE YL-309S Automatický skládací výškově nastavitelný cestovní/přenosný elektrický skútr YL-309S je chytrý elektrický skútr navržený pro pohodlné cestování. Vyznačuje se automatickým skl... -
 YL-985SZOBRAZIT VÍCE YL-985S 4kolový lehký přenosný skládací cestovní elektrický skútr Vlastnosti: Tento mobilní skútr připravený na cesty je vyroben s lehkým, ale odoln...
YL-985SZOBRAZIT VÍCE YL-985S 4kolový lehký přenosný skládací cestovní elektrický skútr Vlastnosti: Tento mobilní skútr připravený na cesty je vyroben s lehkým, ale odoln... -
 YL-985ZOBRAZIT VÍCE YL-985 4kolová skládací elektrická přepravní koloběžka na baterie Vlastnosti: Tento lehký elektrický skútr navržený s ohledem na přenosnost a snadné...
YL-985ZOBRAZIT VÍCE YL-985 4kolová skládací elektrická přepravní koloběžka na baterie Vlastnosti: Tento lehký elektrický skútr navržený s ohledem na přenosnost a snadné... -
 YL-211AZOBRAZIT VÍCE YL-211 4kolová turistická elektrická koloběžka pro seniory s LED světlometem, košík Popis produktu: Tento skládací elektrický skútr určený pro moderní městský život s...
YL-211AZOBRAZIT VÍCE YL-211 4kolová turistická elektrická koloběžka pro seniory s LED světlometem, košík Popis produktu: Tento skládací elektrický skútr určený pro moderní městský život s... -
 YL-02ZOBRAZIT VÍCE YL-02 Lehký 4kolový mobilní skútr pro seniory, vybavený sedadlem otočným o 360° Popis produktu: Rám: Rám je vyroben z pevné a odolné oceli a zajišťuje stabilní ...
YL-02ZOBRAZIT VÍCE YL-02 Lehký 4kolový mobilní skútr pro seniory, vybavený sedadlem otočným o 360° Popis produktu: Rám: Rám je vyroben z pevné a odolné oceli a zajišťuje stabilní ... -
 YL-09BZOBRAZIT VÍCE YL-09B Skládací 4kolový lehký mobilní skútr s košíkem Vlastnosti: Tato mobilní koloběžka s robustním ocelovým rámem zajišťuje stabilní v...
YL-09BZOBRAZIT VÍCE YL-09B Skládací 4kolový lehký mobilní skútr s košíkem Vlastnosti: Tato mobilní koloběžka s robustním ocelovým rámem zajišťuje stabilní v... -
 YL-07ZOBRAZIT VÍCE YL-07 4-kolový skládací elektrický skútr pro mobilitu s košíkem Vlastnosti: Tato skládací mobilní koloběžka spojuje přenosnost s každodenní prakti...
YL-07ZOBRAZIT VÍCE YL-07 4-kolový skládací elektrický skútr pro mobilitu s košíkem Vlastnosti: Tato skládací mobilní koloběžka spojuje přenosnost s každodenní prakti... -
 YL-09SZOBRAZIT VÍCE YL-09S Skládací skútr s dlouhým dojezdem 20 km pro dospělé a seniory Vlastnosti: YL-09S je odolný a všestranný mobilní skútr vyrobený pro každodenní po...
YL-09SZOBRAZIT VÍCE YL-09S Skládací skútr s dlouhým dojezdem 20 km pro dospělé a seniory Vlastnosti: YL-09S je odolný a všestranný mobilní skútr vyrobený pro každodenní po... -
 YL-07TZOBRAZIT VÍCE YL-07T 4kolový přenosný skládací elektrický skútr pro mobilitu Popis produktu: Tento skládací elektrický skútr kombinuje pohodlí a praktičnos...
YL-07TZOBRAZIT VÍCE YL-07T 4kolový přenosný skládací elektrický skútr pro mobilitu Popis produktu: Tento skládací elektrický skútr kombinuje pohodlí a praktičnos... -
 YL-08SZOBRAZIT VÍCE YL-08S Heavy Duty 4-kolová skládací mobilní koloběžka s 12° stoupací kapacitou Nejdůležitější: Stabilní a odolná konstrukce: Tato koloběžka je vyrobena z vysoce ...
YL-08SZOBRAZIT VÍCE YL-08S Heavy Duty 4-kolová skládací mobilní koloběžka s 12° stoupací kapacitou Nejdůležitější: Stabilní a odolná konstrukce: Tato koloběžka je vyrobena z vysoce ... -
 YL-01SZOBRAZIT VÍCE YL-01S 4kolový přenosný skládací motorizovaný skútr pro seniory Vlastnosti: Tento skládací elektrický skútr určený pro moderní cestování na kr...
YL-01SZOBRAZIT VÍCE YL-01S 4kolový přenosný skládací motorizovaný skútr pro seniory Vlastnosti: Tento skládací elektrický skútr určený pro moderní cestování na kr... -
 YL-16ZOBRAZIT VÍCE YL-16 4kolový handicapovaný skútr s pohonem do každého terénu Vlastnosti: Elektrický skútr All-Terrain Electric Mobility Scooter zkonstruovaný p...
YL-16ZOBRAZIT VÍCE YL-16 4kolový handicapovaný skútr s pohonem do každého terénu Vlastnosti: Elektrický skútr All-Terrain Electric Mobility Scooter zkonstruovaný p...
Zvyk Odolný elektrický skútr Výrobci
Mobility Scooter jsou hlavní technologickou inovací v moderní dopravě, která nabízí bezpečný, pohodlný a efektivní způsob cestování pro osoby s omezenou pohyblivostí nebo pro každého, kdo hledá pohodlí.
Mobility Scooter, postavený na pokročilých výrobních procesech a spolehlivých systémech elektrického pohonu, se stal známým v každodenním životě.
Strukturálně se elektrický skútr obvykle skládá z odolného rámu, sedadla, ovládací rukojeti, pneumatik a systému jádra napájení a baterií. Rám je vyroben z vysoce pevných a lehkých materiálů pro zajištění stability a přenosnosti. Sedadlo má ergonomický design a poskytuje komfortní zážitek i při delších jízdách.
Tyto koloběžky nabízejí spoustu funkcí nad rámec základního pohybu. Většina našich modelů je vybavena osvětlovacími systémy pro zajištění bezpečnosti při cestování v noci nebo za snížené viditelnosti. Některé modely vyšší třídy také obsahují nastavitelnou výšku sedadla a úhly opěradla, aby vyhovovaly individuálním potřebám různých uživatelů.
Pokud jde o cílové uživatele, Mobility Scooter milují zejména senioři, kteří jim pomáhají snadno zvládat každodenní pochůzky, pohodové výlety a další. Poskytují také novou nezávislost lidem se zdravotním postižením nebo lidem v rehabilitaci, výrazně zlepšují kvalitu života a zjednodušují a zpříjemňují cestování.
-
Pozadí oboru a význam aplikace Stárnoucí globální populace a zvyšující se poptávka po dostupných řešeních mobility ve zdravotnictví těžké 4k...
ČTĚTE VÍCE -
Zázemí odvětví a význam aplikace The skládací elektrický invalidní vozík se stala kritickou platformou mobility na zdravotnických, instit...
ČTĚTE VÍCE -
The zvedák pacienta z hliníkové slitiny je nezbytným zařízením v moderních zdravotnických zařízeních, navrženým tak, aby napomáhal bezpečném...
ČTĚTE VÍCE -
Údržba a čištění handicapové koloběžky je nezbytné zajistit jejich optimální výkon, životnost a bezpečnost . Správná péče nejen prodl...
ČTĚTE VÍCE -
Vzhledem k tomu, že hustota městského provozu neustále roste, kompaktní řešení mobility získávají širší uplatnění pro cestování na krátké vzdálenos...
ČTĚTE VÍCE
Jak zajistit, aby systém pohonu elektrického skútru splňoval normy odolnosti FDA a CE certifikace?
Základní požadavky certifikace FDA a CE na odolnost systému pohonu
FDA (U.S. Food and Drug Administration) klasifikuje odolné elektrické skútry jako lékařské pomůcky. Jeho normy odolnosti se zaměřují na bezpečnost, spolehlivost a přizpůsobivost scénáře použití pacientem. Vyžaduje, aby napájecí systém neměl žádné funkční poruchy během očekávané životnosti (obvykle 5-10 let), se zvláštním zřetelem na ochranu motoru proti přehřátí, návrh zamezení vytečení baterie a stabilitu řídicího systému. CE certifikace (EU Conformity Certification) vychází ze směrnice o strojních zařízeních (2006/42/ES) a směrnice o nízkém napětí (2014/35/EU), klade důraz na mechanickou pevnost, elektrickou bezpečnost a přizpůsobivost prostředí. Například napájecí systém musí projít testem vodotěsnosti a prachuvzdornosti IP54, testem teplotního cyklu -20 ℃ až 50 ℃ a nepřetržitá provozní životnost motoru při jmenovité zátěži musí být ≥ 10 000 hodin.
Mezi společné požadavky těchto dvou patří:
Odolnost materiálu: klíčové komponenty musí odolávat stárnutí a korozi a musí splňovat směrnici RoHS na ochranu životního prostředí;
Životnost cyklu: míra zachování kapacity baterie po ≥1000 cyklech nabití a vybití je ≥80 %;
Stabilita zátěže: při jmenovité zátěži (např. 150 kg) je rozsah kolísání výkonu ≤±5%;
Odolnost proti poruchám: systém musí mít ochranu proti přetížení, odpojení proti zkratu a funkce varování při poruchách.
Technická cesta a implementační strategie pro zajištění životnosti systému pohonu
(I) Optimalizace materiálu a konstrukce hlavních komponent
Odolná konstrukce motorického systému
Jako výkonové jádro závisí životnost motoru na materiálu vinutí, konstrukci odvodu tepla a životnosti ložisek. Například použití permanentních magnetů NdFeB ke zlepšení odolnosti magnetické oceli proti demagnetizaci v kombinaci s plně uzavřenou vodou chlazenou konstrukcí pro odvod tepla může řídit provozní teplotu motoru pod 80 °C (FDA požaduje, aby teplota krytu motoru byla ≤95 °C). Suzhou Heins Medical Equipment Co., Ltd. začleňuje patentovanou technologii do konstrukce motoru. Jeho systém řízení motoru optimalizuje výstup točivého momentu pomocí algoritmu vektorového řízení FOC a snižuje dopad proudu během startování/brždění. Po testování může prodloužit životnost ložisek motoru na více než 20 000 hodin, čímž splňuje požadavky na dlouhodobý provoz certifikace CE.
Řízení životnosti bateriového systému
Baterii je třeba chránit jak systémem řízení teploty, tak systémem řízení baterií BMS. Bateriový modul je obalený hliníkovým pláštěm letecké třídy a kompozitním materiálem z uhlíkových vláken, který může nejen zlepšit strukturální pevnost (odolnost vůči vytlačování 1000N bez deformace), ale také dosáhnout ±2℃ regulace teplotního rozdílu pomocí vestavěného tepelně vodivého silikonu (FDA vyžaduje rozsah provozní teploty baterie -10℃~45℃). BMS potřebuje monitorovat napětí, teplotu a rychlost nabíjení a vybíjení jednotlivých článků v reálném čase. Když se napětí bateriového článku odchýlí od průměrné hodnoty o ≥5 %, systém automaticky spustí vyvažovací ochranu, aby se zabránilo útlumům životnosti způsobené přebíjením a přebíjením. Řešení baterie bylo testováno třetí stranou a míra zachování kapacity dosahuje 85 % po 1000 cyklech nabití a vybití 1C, což překračuje základní požadavky certifikace CE.
Návrh spolehlivosti regulátoru a přenosové soustavy
Regulátor potřebuje použít třívrstvý nátěr (odolný proti vlhkosti, prachu a soli), aby splnil stupeň ochrany IP65, aby se vyrovnal s venkovním vlhkým prostředím. Převodovka musí projít zkouškou abrazivního opotřebení. Například se používají nauhličovaná a kalená kola 20CrMnTi a tvrdost povrchu zubů dosahuje HRC58-62. Po 5000 hodinách zátěžového provozu je opotřebení povrchu zubu ≤0,05 mm. Konstrukce přenosového článku je optimalizována v patentu skládací konstrukce. Snížením vůle záběru ozubených kol (≤0,02 mm) se sníží provozní hluk a zlepší se životnost převodového systému.
(II) Kontrola kvality výrobního procesu a dodavatelského řetězce
Zajištění přesnosti špičkového výrobního zařízení
Přesnost zpracování základních součástí energetického systému přímo ovlivňuje životnost. Například německý laserový řezací stroj TRUMPF používaný společností Suzhou Heins Medical Equipment Co., Ltd. může dosáhnout přesnosti řezání 0,01 mm pro plechy z motorové křemíkové oceli a snížit ztráty jádra; Japonská robotická svařovací stanice Yaskawa používá technologii sledování oblouku, aby byla pevnost svařovacího ucha baterie ≥50N, čímž se zabrání zvýšení kontaktního odporu způsobeného falešným svařováním (CE vyžaduje zvýšení teploty svařovacího bodu ≤30K). Bezprašná dílna (úroveň ISO8) její moderní výrobní základny o rozloze 20 000 metrů čtverečních dokáže zajistit, že částice nečistot při svařování desky plošných spojů ovladače jsou ≤0,5μm, čímž se snižuje riziko zkratu.
Řízení plně procesní sledovatelnosti dodavatelského řetězce
Klíčové komponenty (jako jsou magnety motoru a bateriové články) musí pocházet od dodavatelů, kteří prošli certifikací IATF16949, a každá šarže materiálů musí poskytovat certifikaci materiálu a zprávy o zkouškách spolehlivosti. Například článek baterie musí projít testem propíchnutí jehlou UL1642 (žádný požár a výbuch) a ložisko motoru musí poskytnout certifikaci životnosti značek jako SKF nebo FAG (životnost L10 ≥50 000 hodin). Efektivní systém řízení dodavatelského řetězce může dosáhnout úplné sledovatelnosti procesu od skladování surovin až po dodání hotového produktu, což zajišťuje, že každá součást systému pohonu splňuje požadavky na shodu materiálu FDA a CE.
(III) Vícerozměrný testovací systém a ověřování shody s certifikací
Test odolnosti simulující scénáře použití
Mechanický zátěžový test: Upevněte robustní mobilní skútr na vibrační stůl, simulujte drsné podmínky na vozovce s frekvencí 3 Hz a amplitudou ±50 mm a běžte nepřetržitě po dobu 500 hodin, abyste otestovali únavovou pevnost držáku motoru a držáku baterie (FDA požaduje, aby konstrukční díly neměly žádné praskliny a šrouby nebyly uvolněné).
Test cyklů prostředí: V komoře s vysokou a nízkou teplotou a vlhkostí cyklujte při -20℃~50℃ (každý teplotní bod je udržován po dobu 8 hodin) a aplikujte 95% vlhkost po 100 cyklů, abyste ověřili odolnost elektronických součástek ovladače vůči povětrnostním vlivům (CE vyžaduje, aby izolační odpor po testování byl ≥10MΩ).
Test životního cyklu: Nepřetržitě jezděte se jmenovitým zatížením (150 kg), zaznamenávejte teplotu motoru, útlum kapacity baterie a poruchovost ovladače, dokud nedojde k prvnímu funkčnímu selhání, a požadujte střední dobu mezi poruchami (MTBF) ≥ 10 000 hodin (standard FDA pro zdravotnické zařízení).
Ověření shody certifikační agenturou třetí strany
Po absolvování interního testu je nutné pověřit laboratoř schválenou FDA (např. UL, TÜV), aby provedla kompletní testování. Například bateriový systém musí projít testem bezpečnosti přepravy UN38.3 (povinný požadavek pro certifikaci CE), motor musí projít testem účinnosti EN 60034-1 (úroveň IE3 nebo vyšší) a ovladač musí splňovat normu elektromagnetické kompatibility EN 61000-6-3. Během certifikačního procesu předloží produkty Suzhou Heins Medical Equipment Co., Ltd. kompletní technickou dokumentaci včetně konstrukčních výkresů, zkušebních zpráv a certifikace materiálů, aby bylo zajištěno, že každý odkaz bude sledovatelný.
(IV) Systém managementu kvality a mechanismus neustálého zlepšování
Plná kontrola procesu podle norem ISO
Na základě požadavků ISO 13485 (Systém managementu kvality pro zdravotnické prostředky) a ISO 9001 musí výroba systémů pohonu projít:
Ověření návrhu (DV): Identifikujte potenciální rizika pomocí FMEA (Analýza režimu poruch) během fáze výzkumu a vývoje. Například, když je úroveň rizika přehřátí motoru ≥8, je nutné přidat redundantní konstrukci teplotních čidel;
Ověření procesu (PV): Provádí se monitorování CPK (Process Capability Index) klíčových procesů, jako je svařování a montáž, a pro zajištění stability procesu je vyžadováno CPK ≥ 1,33;
Kontrola hotového výrobku (FQC): Každý napájecí systém musí projít 100% funkčním testováním (jako je proud naprázdno, doba odezvy ochrany proti přetížení) a FDA vyžaduje poruchovost ≤ 0,1 %.
Optimalizace trvanlivosti na základě dat po prodeji
Analyzujte poruchové režimy prostřednictvím záručních záznamů. Pokud se například kapacita šarže baterií po 1 roce používání příliš rychle sníží, je nutné vysledovat vzorec elektrolytu nebo proces tvorby výrobní šarže a včas upravit parametry. Pro sledování celého cyklu od dodávky dílů až po realizaci projektu byl vytvořen kompletní systém zpětné vazby od zákazníků. Údaje o poruchách shromážděné jeho poprodejním týmem budou pravidelně zasílány zpět do oddělení výzkumu a vývoje pro iteraci trvanlivosti příští generace produktů, což zajistí soulad s požadavky FDA na „řízení životního cyklu“ zdravotnických prostředků.